En junio de 2017, durante su discurso de inauguración en la reunión anual de la Sociedad Americana de Oncología Clínica, Siddartha Mukherjee mostró una foto de su amigo Will Kiersky. Con poco más de treinta años, le diagnosticaron un melanoma que se había extendido a los ganglios linfáticos del mentón. El pronóstico era espantoso.
Kiersky respondió al primer tratamiento con inmunoterapia, pero un año después tuvo una recaída que superó con una nueva combinación de fármacos. Mukherjee, oncólogo y autor de El emperador de todos los males, uno de los mejores libros escritos sobre el cáncer, recordó que mirando la antigua foto habría identificado como culpable de la enfermedad una pequeña marca negra en su mejilla. Se habría equivocado. El origen del mal estaba en una lesión mucho más pequeña, benigna a sus ojos, en la parte superior de su frente.
Mientras un tumor permanece en su órgano de nacimiento, las posibilidades de mantenerlo bajo control y extirparlo con cirugía y radioterapia son muchas. Cuando sus células comienzan a colonizar otras partes del cuerpo con la metástasis la situación se complica. Mukherjee mencionó los algoritmos en desarrollo capaces de detectar y clasificar las lesiones malignas con mucha más precisión que los humanos. “Uno de los pioneros de este campo imagina un mundo en el que estamos bajo constante vigilancia diagnóstica. Una bañera realizaría una exploración mientras te bañas, a través de inocuos ultrasonidos o resonancia magnética, para determinar si un nuevo bulto en el ovario requiere análisis y el Big Data te vigilaría, registraría y evaluaría”, especuló el médico.
“Es difícil no caer seducido por esta idea [que permitiría] atrapar el cáncer en sus etapas iniciales”, reconoció. Pero después recordó que muchos cánceres no tienen consecuencias letales, “morimos con ellos, no por ellos”. ¿Qué pasaría si una máquina de diagnóstico inmersivo así llevase a realizar millones de biopsias innecesarias? “En medicina, hay casos en los que un diagnóstico precoz puede salvar o prolongar la vida. También hay casos en los que estarás preocupado más tiempo, pero no vivirás más. Es difícil saber cuánto quieres saber”, concluía.
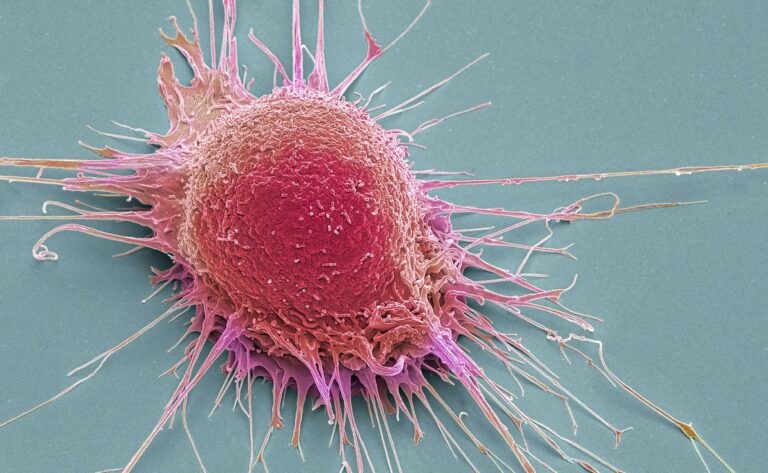
Esta semana, la revista Nature publicó los resultados de un estudio descomunal. Científicos de medio mundo aglutinados en el proyecto Pan-Cáncer analizaron el genoma completo de más de 2.600 personas que sufrían 38 tipos de tumores diferentes. El resultado ofrece la visión más detallada de cómo y por qué surge cada tipo de cáncer a nivel molecular y es un paso para detectar el mal cuando se está gestando, mucho antes de que los daños sean irreversibles.
“Este tipo de estudios nos ayudan a entender los procesos de formación del cáncer”, señala Josep Tabernero, director del Instituto de Oncología Vall d’Hebron (VHIO, de sus siglas en inglés) de Barcelona. “Una idea que teníamos hace tiempo y estaba equivocada es que cuando tenías una alteración en un gen determinado a continuación aparecía el cáncer, y esto no es así”, explica. “En un cáncer de pulmón pueden aparecer mutaciones en una célula bronquial mucho antes de que se manifieste, cuando empiezas a fumar en la juventud, por ejemplo, y entender cómo se van produciendo estas alteraciones evolutivamente nos puede ayudar a diseñar formas de tratar los tumores o de prevenirlos”, añade. El estudio ha estimado que, de media, el cáncer necesita cinco mutaciones causales para aparecer, aunque la cifra varía dependiendo del tipo de tumor.
Los grandes análisis genómicos son una forma de completar el rompecabezas de una enfermedad que aún se conoce poco. “Cuando comparamos genomas de diferentes enfermedades vemos que algunas de sus características no son exclusivas de un cáncer concreto. La alteración HER2, que se puede tratar con trastuzumab [un medicamento dirigido específicamente a esa mutación que salvó la vida de muchas mujeres que antes tenían el peor pronóstico] se encontró después en algunos tumores gástricos, y se pudo aplicar el mismo medicamento, que también funciona en pequeños porcentajes de cáncer de pulmón y colon”, continúa Tabernero. Lo que definía la enfermedad y su tratamiento no era solo el órgano en el que se encontraba sino las mutaciones que lo habían originado.
Javier Cortés, jefe de los Equipos de Cáncer de Mama y de Tumores Ginecológicos del Hospital Universitario Ramón y Cajal de Madrid, destaca también el hallazgo de que algunas de las alteraciones que producen los tumores “estaban presentes incluso años antes en algunas células”. “Si pudiéramos identificar esas alteraciones prematuras meses o años antes de que se desarrolle un cáncer, podríamos atacar esas alteraciones antes de que se manifiesten”, afirma. No obstante, pone cautelas. “Que una célula adquiera una mutación que comparte con muchos tumores no significa que de forma inevitable vaya a formar un tumor, porque el sistema inmunológico podría eliminarla. Además, si decidiéramos tratar esa alteración tendríamos que hacerlo con tratamientos dirigidos y ver qué efectos secundarios producen”, afirma. Por último, señala la necesidad de un sistema de detección como la biopsia líquida, un análisis de sangre que busca señales de mutaciones peligrosas en la sangre del paciente. “En un tejido no sabes dónde están estas células, así que tienes que mirar en la sangre, la saliva o la orina, algo que te de información de todo el cuerpo”, indica.
Enriqueta Felip, vicepresidenta de la Sociedad Española de Oncología Médica (SEOM), señala que ahora ya se hace “un análisis molecular en algunos genes concretos para algunos pacientes concretos”. “El número de marcadores que analizamos en cada patología va aumentando, pero también es cierto que ahora no tiene sentido hacer el análisis del genoma completo para tratar a un paciente. Además de por el coste, porque tenemos que decidir el tratamiento en dos o tres semanas”, explica Felip. Sobre el proyecto Pan-Cáncer comenta que estos resultados abren la puerta a abordajes terapéuticos más personalizados, aunque “es difícil prever lo que queda para que se materialicen”. “De momento es necesario secuenciar muchos más tumores en muchos más pacientes para completar la información, y es necesario incluir su evolución clínica” para estimar mejor el valor de cada mutación, añade.
Los interrogantes sobre cómo se podrán emplear las cantidades ingentes de información que se acumulará con la secuenciación masiva de genomas y la capacidad descomunal de análisis que ofrece la bioinformática aún son muchos. Mukherjee advertía de los riesgos de esta tecnología en una enfermedad como el cáncer, que tiene muchas probabilidades de aparecer si se vive lo suficiente. La enfermedad se puede convertir en una “institución total” en la que el paciente es constantemente vigilado y al que se le recuerda con demasiada frecuencia la amenaza de la muerte. Será un dilema difícil de resolver. Menos de un año después del discurso del oncólogo estadounidense, con solo 35 años, fallecía su amigo William Kiersky. Para salvarlo, habría podido soportar cualquier exceso de conocimiento.
Tomado de: https://elpais.com/